Apa itu energi ionisasi ?
- Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron yang
- terikat paling lemah oleh suatu atom-atom atau ion dalam wujud gas.
- Elektron yang paling lemah adalah yang terletak di kulit paling luar.
- Energi ionisasi adalah salah satu sifat dari sistem periodik unsur.
• energi
ionisasi (Ei)untuk mengeluarkan satu
elektron pertama (dari atom netralnya) disebut sebagai energi
ionisasi pertama dan untuk mengeluarkan satu
elektron ke dua disebut energi ionisasi kedua, dan begitu seterusnya.
• mengeluarkan
satu elektron pertama dari atom netralnya akan lebih mudah daripada
mengeluarkan satu elektron kedua dan seterusnya dari kation yang bersangkutan
karena pengaruh muatan inti menjadi semakin lebih efektif (semakin kuat)
terhadap elektron yang semakin berkurang jumlahnya.
Sifat Energi ionisasi
•Besarnya energi ionisasi
merupakan ukuran mudah tidaknya elektron terikat dengan inti
atom.
•Semakin besar energi ionisasi, semakin kuat elektron menempel pada inti
atom
•Energi ionisasi dan kekuatan elektron berbanding lurus.
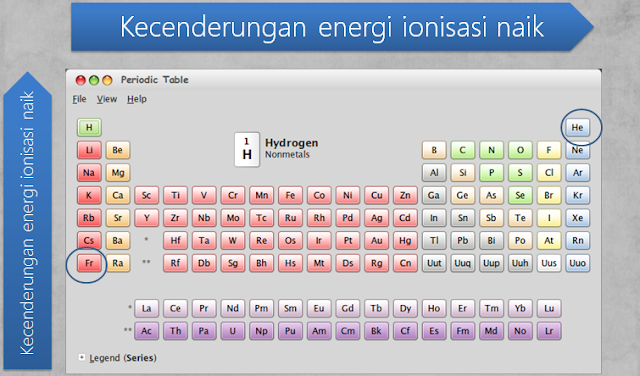
Perbandingan energi ionisasi
unsur-unsur
*Helium
mempunyai energi ionisasi terbesar,
itulah sebabnya helium diletakkan pada pojok
kanan atas pada tabel periodik sedangkan Fr
mempunyai Energi ionisasi terkecil sehingga
diletakkan pada pojok
kiri bawah.
Kecenderungan
energi ionisasi dalam sistem periodik unsur
*Energi
ionisasi unsur-unsur dalam satu periode dari kiri ke kanan cenderung semakin
besar, dan energi ionisasi unsur-unsur segolongan dari bawah ke atas semakin
besar.
Hubungan energi ionisasi dengan jari-jari atom
•Besarnya
energi ionisasi suatu atom dipengaruhi oleh ukuran jari-jari atom atau jarak
elektron pada kulit terluar dengan inti atom.
•Semakin
panjang jari-jari atom, semakin jauh elektron pada kulit terluar dengan inti
atom sehingga gaya tarik inti terhadap elektron lemah.
“Semakin panjang jari-jari atom,
semakin kecil energi ionisasinya”
please leave a comment :)







0 comments:
Post a Comment